Cyanurate


Cet article ne cite pas suffisamment ses sources ().
Si vous disposez d'ouvrages ou d'articles de référence ou si vous connaissez des sites web de qualité traitant du thème abordé ici, merci de compléter l'article en donnant les références utiles à sa vérifiabilité et en les liant à la section « Notes et références ».
En pratique : Quelles sources sont attendues ? Comment ajouter mes sources ?
Un cyanurate est un ion formant des sels et des esters de l'acide cyanurique qui consiste en un cycle 1,3,5-triazine de trois unités –C(OH)=N–. C'est la base conjuguée de cet acide. Les cyanurates peuvent être obtenus par trimérisation de cyanates ou d'isocyanates, réaction au cours de laquelle ceux-ci peuvent aussi polymériser pour former des polycyanurates et des polyisocyanurates.
-
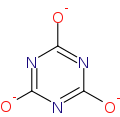 ion cyanurate
ion cyanurate -
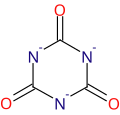 ion isocyanurate
ion isocyanurate
De fait, l'acide cyanurique [–C(OH)=N–]3 est tautomère de l'acide isocyanurique [–C(=O)–NH–]3. Par exemple, sur le cyanurate de triallyle, de numéro CAS 101-37-1[1], les radicaux allyles sont liés à l'atome d'oxygène, [–C(O–CH2CH=CH2)=N–]3, tandis que pour l'isocyanurate de triméthyle, CAS#827-16-7, les radicaux méthyles sont liés à l'atome d'azote, [–C(=O)–N(CH3)–]3.
Dans certains composés comme le dichloroisocyanurate de sodium, certaines unités du cycle actent sous forme O-base (cyan...) tandis que les autres sous forme N-base (isocyan...).
Notes et références
- ↑ PubChem 7555
 Portail de la chimie
Portail de la chimie














