Nitrogenoksid
Nitrogenoksider (NOX) er kjemisk forbindelser av oksygen og nitrogen. Nitrogenoksider løser seg lett i vann og danner salpetersyre.
Nitrogenoksider oppstår på flere måter, noen av de vanlige er under forbrenning der N og O slår seg sammen til å lage NO og NO2. Andre måter er under reaksjoner med salpetersyre eller nitratsalter kan NOx gasser dannes.
Atmosfæren
I atmosfæren er det små mengder av NO2 og NO i fra hovedsakelig biler og industrielle produksjoner.[1] Sollys katalyserer reduksjon av N i reaksjonen NO2 til NO. Nitrogenoksid er, sammen med svovel, derfor en viktig bidragsyter til sur nedbør.
Ulike oksidasjonstrinn for N
Nitrogen kan ha alle oksidasjonstall fra +5 til -3.
NOx kan bety følgende oksider (oksygen forbindelser) av nitrogen, eller en blanding:
- Nitrogenmonoksid (NO), nitrogen(II)oksid
- Nitrogendioksid (NO2)
- Dinitrogenmonoksid (N2O), nitrous oxide
- Dinitrogentrioksid (N2O3), nitrogen (III) oxide
- Dinitrogentetroksid (N2O4)
- Dinitrogenpentoksid (N2O5)
-
 Nitrogenoksid, NO
Nitrogenoksid, NO -
 Nitrogendioksid, NO2
Nitrogendioksid, NO2 -
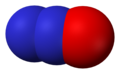 Dinitrogenmonoksid, N2O
Dinitrogenmonoksid, N2O -
 Dinitrogentrioksid, N2O3
Dinitrogentrioksid, N2O3 -
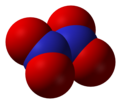 Dinitrogen tetroksid, N2O4
Dinitrogen tetroksid, N2O4 -
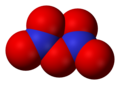 Dinitrogen pentoksid, N2O5
Dinitrogen pentoksid, N2O5
Forurensning
Oksider av nitrogen og svovel i atmosfæren skyldes for en stor del forurensning av luften som kalles fotokjemisk smog.
Referanser
- ^ «Nitrogendioksid». Folkehelseinstituttet (norsk). Besøkt 8. mars 2023.
Se også
Eksterne lenker
- https://www.fhi.no/nettpub/luftkvalitet/temakapitler/nitrogendioksid2/














