Oxoàcid
Un oxoàcid és un compost químic que conté oxigen, almenys un altre element i almenys un hidrogen lligat a l'oxigen, , i que produeix una base conjugada per la pèrdua d'ions d'hidrogen (hidrons) positius, . Son exemples d'oxoàcids inorgànics l'àcid nítric , l'àcid sulfúric i l'àcid fosfòric .[1][2] Qualsevol àcid carboxílic és un exemple d'oxoàcid orgànic.[3]
-
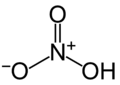 Estructura de l'àcid nítric
Estructura de l'àcid nítric -
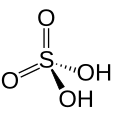 Estructura de l'àcid sulfúric
Estructura de l'àcid sulfúric -
 Estructura de l'àcid fosfòric
Estructura de l'àcid fosfòric -
 Estructura de l'àcid acètic
Estructura de l'àcid acètic
Els oxoàcids inorgànics presenten enllaços del tipus hidrogen-oxigen-heteroàtom amb una fórmula general . Si és un no-metall o un metal·loide, aquestes espècies acostumen a ser àcids de Brønsted. Amb molt poques excepcions, principalment els oxoàcids de fòsfor, l'hidrogen està enllaçat exclusivament amb l'oxigen i no amb l'heteroàtom.
La força àcida dels oxoàcids depèn de diversos factors. Si té més d'un hidrogen ionitzable, les constants d'acidesa segueixen l'ordre Ka1 > Ka2 > Ka3. Com a regla general, les successives constants d'acidesa estan separades per uns cinc ordres de magnitud, per exemple per a l'àcid fosfòric : pKa1 = 2,1, pKa2 = 7,2 i pKa3 = 12,4. Les reaccions són:
Per altra banda l'acidesa és més gran com més electronegatiu és l'heteroàtom. Per exemple el valor de Ka augmenta segons la sèrie ja que les electronegativitats d'aquest heteroàtoms d'un mateix període de la taula periòdica varien igual: 2,1 < 2,5 < 3,0. També l'acidesa augmenta en la sèrie d'oxoàcids d'elements del mateix grup de la taula periòdica, com ara els halògens. Així hom troba la l'ordre perquè les electronegativitats augmenten: 2,5 < 2,8 < 3,0. A més, l'acidesa s'incrementa per l'addició de grups atraients d'electrons, com o , sobre l'heteroàtom, per exemple . Finalment l'acidesa augmenta en augmentar el nombre d'àtoms d'oxigen que conté l'oxoàcid. Per exemple, per als oxoàcids del clor, Ka augmenta en el sentit . De nou aquí la diferència entre les successives constants d'acidesa és d'aproximadament cinc ordres de magnitud.[3]
Us industrial

Els oxoàcids més importants des del punt de vista industrial són l'àcid sulfúric i l'àcid nítric. L'àcid sulfúric és un dels productes químics industrials de major volum produïts al món. La producció de fertilitzants, especialment els fertilitzants a partir d'àcid fosfòric de procés humit, és el principal mercat d'ús final de l'àcid sulfúric, que representa més del 60% del consum mundial total el 2017. La Xina és el principal mercat, que representà més del 37% del consum el 2017, seguit d'Amèrica del Nord amb prop d'un 16%.[4] Se'n produeixen aproximadament 165 milions de tones anuals a tot el món.[5] El mercat més gran d'àcid nítric és la producció de nitrat d'amoni i nitrat d'amoni i calci , que representà gairebé el 77% del consum mundial d'àcid nítric el 2016. L'ús final principal del nitrat d'amoni per a fertilitzants està en davallada degut a les preocupacions sobre la contaminació per nitrats i problemes de seguretat, ja que pot emprar-se com explosiu.[6] La producció el 2016 fou de 62,2 milions de tones.[7]
Referències
- ↑ «oxoàcid | enciclopèdia.cat». [Consulta: 5 novembre 2019].
- ↑ «IUPAC - oxoacids (O04374)». IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Blackwell Scientific Publications, 1997. DOI: 10.1351/goldbook. [Consulta: 5 novembre 2019].
- ↑ 3,0 3,1 «Diccionari de química | TERMCAT». [Consulta: 5 novembre 2019].
- ↑ «Sulfuric Acid - Chemical Economics Handbook (CEH) | IHS Markit». [Consulta: 5 novembre 2019].
- ↑ «Sulfuric Acid» (en anglès). [Consulta: 5 novembre 2019].
- ↑ «Nitric Acid - Chemical Economics Handbook (CEH) | IHS Markit». [Consulta: 5 novembre 2019].
- ↑ «Nitric Acid» (en anglès). [Consulta: 5 novembre 2019].












![{\displaystyle {\ce {H3PO4 + H2O <=>[K_{a1}] H2PO4- + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b73d07288375e82e18b6616117a48908291d390)
![{\displaystyle {\ce {H2PO4- + H2O <=>[K_{a2}] HPO4^2- + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dc6a469590f941ea1770cdc0c450be1cd0684927)
![{\displaystyle {\ce {HPO4^2- + H2O <=>[K_{a3}] PO4^3- + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e807c416a1567434b1f8706b1716cc61aaac599)








